Yaşamın taslağı olan DNA’ya ilişkin anlayışımız dikkate değer bir evrim geçirdi. Onlarca yıl boyunca genomu, proteinlerin üretimini belirleyen bir A, T, C ve G dizisinden ibaret olan doğrusal bir kod dizisi olarak gördük. Ancak bu tek boyutlu görüş temel olsa da, tüm hikâyeyi anlatmaz ve burada devreye DNA dizimizin “üstündeki” bilgi katmanlarını inceleyen büyüleyici bir alan olan epigenetik girer.
Onur Baloğlu
Epigenetik değişiklikler DNA’mızın harflerini değiştirmez, ancak hangi genlerin ne zaman ve nerede açılıp kapatılacağını etkiler. Metil grupları ve histon değişiklikleri gibi kimyasal etiketler, iyi bilinen epigenetik oyuncular olsa da epigenetik düzenlemenin eşit derecede önemli ve belki de görsel olarak daha şaşırtıcı bir yönü, genomumuzun üç boyutlu mimarisinde yatmaktadır. Hücre çekirdeğinin mikroskobik sınırları içerisinde son derece uzun DNA moleküllerimizin katlanma ve organize olma biçimi, yaşamın düzenlenmesinde dinamik ve kritik bir faktördür.
Gen ifadesi ve düzene ihtiyaç: 3D organizasyon neden önemlidir
Hücresel işlevin merkezinde gen ifadesi süreci yatar. DNA’nın belirli bölümleri olan genler, protein oluşturma talimatlarını taşır. Bir gen “ifade edildiğinde”, DNA dizisi önce bir haberci RNA (mRNA) molekülüne aktarılır ve bu molekül daha sonra protein sentezi için bir şablon görevi görür. Bu süreç basit bir “açık/kapalı” meselesi değildir ve kusursuz çalışması için kompleks bir düzen içindedir. “Promoter” olarak bilinen özel DNA dizileri, transkripsiyonu başlatan hücresel makine için yerleştirme noktaları olarak işlev görür. Güçlendiriciler (enhancers) olarak adlandırılan diğer diziler, bir genin aktivitesini önemli ölçüde artırabilirken; susturucular (repressors) onu azaltabilir veya kapatabilir. İlginç bir şekilde, bu düzenleyici unsurlar doğrusal dizide kontrol ettikleri genlerden binlerce, hatta yüz binlerce DNA harfi uzakta bulunabilir. Bu, hemen bir soruyu gündeme getirir: Bu uzak unsurlar hedef genleriyle nasıl iletişim kurar?
Epigenetik değişiklikler DNA’mızın harflerini değiştirmez, ancak hangi genlerin ne zaman ve nerede açılıp kapatılacağını etkiler.
Cevap, “paketleme problemi” ile başlar. Çapı sadece birkaç mikrometre olan her insan hücre çekirdeği, yaklaşık iki metre DNA’yı barındırmalıdır. Bu inanılmaz sıkıştırma başarısını elde etmek için DNA, histon adı verilen proteinlerin etrafına sarılır ve kromatin adı verilen bir kompleks oluşturur. Bu kromatin daha sonra daha fazla ilmeklenir, kıvrılır ve katlanır. Uzun bir süre boyunca, bu karmaşık paketlemenin bir şekilde rastgele olduğu, öncelikle bir depolama çözümü olduğu düşünüldü. Ancak bilim insanları, bu karmaşık katlamanın düzenleyici bulmacanın önemli bir parçası olup olmadığını merak etmeye başladılar. Genomun 3D mimarisi, uzaktaki güçlendiricileri ve promotörleri fiziksel olarak yakın bir mesafeye getirebilir; bunların etkileşime girmesine ve dolayısıyla gen ifadesini kontrol etmesine izin verebilir mi?
Genomun 3D organizasyonu, genetik bilginin işlenmesinde devrim yaratan yeni bir anlayış alanıdır.
Bu soru, çok uzak olmayan bir geçmişte sorularak, genomun mekânsal organizasyonunu ve bunun derin etkilerini anlamaya adanmış bir alan olan 3D kromozom çalışmalarının başlamasına vesile oldu. Kısaca; genomun 3D organizasyonu, genetik bilginin işlenmesinde devrim yaratan yeni bir anlayış alanıdır. Her kromozom, çekirdek içinde kendine ait bir “teritorya”da bulunur ve bu bölgesel organizasyon, genlerin işlevselliğini etkiler. Katlanma biçimi, DNA bölgelerinin birbirine yakınlığını belirler. Örneğin, bir enhancerdan çıkan sinyalin bir gen promotörüne ulaşması, fiziksel yakınlıkla mümkündür. Bu nedenle DNA’nın nasıl katlandığı, genlerin nasıl okunacağını doğrudan etkiler. Mikroskopi teknikleri bu yapıları görsel olarak ortaya koyarken, daha ayrıntılı haritalama için moleküler biyolojide yeni yöntemler geliştirildi. Bunların en önemlilerinden biri, genom içindeki fiziksel temasları ölçebilen Hi-C tekniğidir.
Genomun mimarisini açığa çıkarmak: Hi-C’nin yükselişi
Genomun görünmez kıvrımlarını görselleştirmek, muazzam bir teknik zorluk teşkil ediyordu. Sürekli sallanırken, inanılmaz derecede uzun, sonsuz derecede ince bir ipliğin minik bir topa sıkıştırılmış kesin düzenini haritalamaya çalıştığınızı hayal edin. FISH gibi erken dönem floresan görüntüleme teknikleri, araştırmacıların belirli DNA dizilerini floresan işaretçilerle etiketlemelerine ve çekirdek içindeki yaklaşık konumlarını görselleştirmelerine olanak tanıyordu. Çığır açıcı olmasına rağmen, FISH aynı anda yalnızca birkaç DNA lokusuna bakabiliyordu ve genom boyunca gerçekleşen tüm etkileşimlerin küresel, yüksek çözünürlüklü bir resmini sunmuyordu. Daha güçlü bir araca ihtiyaç vardı.
Bu ihtiyaca yanıt olarak, 2002 yılında geliştirilen 3C (Chromosome Conformation Capture) yöntemi, genomun üç boyutlu yapısını incelemede bir dönüm noktası oldu. 3C, hücre içindeki DNA bölgeleri arasında fiziksel temas olup olmadığını ortaya koymak için tasarlanmıştı. Temel olarak, hücrelerdeki DNA önce çapraz bağlanarak birbirine temas eden bölgeler “dondurulur”, ardından bu DNA parçaları kesilir ve temas hâlindeki uçlar birleştirilerek yapay bir DNA parçası oluşturulur. Sonrasında, bu birleştirilmiş DNA parçası PCR yöntemiyle çoğaltılarak analiz edilir. Böylece araştırmacılar, belirli iki genetik bölgenin uzayda birbirine yakın olup olmadığını anlayabiliyordu. Ancak 3C, yalnızca önceden belirlenen bölgeler arasındaki etkileşimleri test edebildiği için sınırlıydı. Genom çapında, sistematik bir harita çıkarabilmek için daha kapsamlı bir yöntem gerekiyordu.
“Yüksek Verimli Kromozom Konformasyonu Yakalama” anlamına gelen Hi-C, 3C yönteminin aksine sadece iki DNA bölgesinin birbirine temas edip etmediğini incelemek yerine, genom çapındaki temasları haritalandırabilir.
3C’nin sunduğu bu yeni bakış açısı, daha gelişmiş varyantların da önünü açtı. 4C (Circular Chromosome Conformation Capture) yöntemi, belirli bir DNA bölgesinin tüm genomla olan etkileşimlerini haritalayabiliyordu — yani “birden çoğa” ilişkiler keşfedilebiliyordu. Ardından gelen 5C (Carbon Copy Chromosome Conformation Capture) ise çok sayıda bölgenin birbiriyle olan karşılıklı etkileşimlerini daha geniş çapta incelemeye olanak tanıdı. Ancak bu yöntemlerin tümü hâlâ sınırlı kapsama sahipti ve tüm genomu yüksek çözünürlükte tarayacak güce sahip değildi. Gerçek anlamda küresel, genom çapında ve sistematik bir etkileşim haritası çıkarmanın yolu, Job Dekker’ın laboratuvarı tarafından 2009’da geliştirilen, devrim niteliğinde bir teknik olan Hi-C biçiminde ortaya çıktı. “Yüksek Verimli Kromozom Konformasyonu Yakalama” anlamına gelen Hi-C, 3C yönteminin aksine sadece iki DNA bölgesinin birbirine temas edip etmediğini incelemek yerine, genom çapındaki temasları haritalandırabilir.
Hi-C’nin (genel olarak 3C, 4C, 5C’nin de) temel adımları şunlardır:
- Hücrelerdeki DNA, formaldehit gibi kimyasallarla çapraz bağlanarak fiziksel olarak temas eden bölgeler sabitlenir.
- DNA, restriksiyon enzimleriyle kesilir.
- Temas hâlinde olan DNA uçları birleştirilerek (ligasyon) yapay birleştirme noktaları oluşturulur.
- Bu yeni oluşan DNA parçaları dizilenerek (Next-Gen Sequencing) analiz edilir.
Sonuçta elimizde, DNA’nın hangi bölgelerinin üç boyutlu uzayda birbirine yakın olduğunu gösteren bir “temas matrisi” oluşur. Bu veriler, genlerin nasıl katlandığını, hangi bölgelerin yakınlaştığını ve düzenleyici elemanların nasıl etkileştiğini ortaya koyar. Bir Hi-C deneyinin çıktısı, bu etkileşim frekanslarının devasa bir veri kümesidir. Bu veriler genellikle bir ısı haritası — her eksenin doğrusal genomu temsil ettiği ve her pikselin renk yoğunluğunun karşılık gelen genomik lokuslar arasındaki etkileşim sıklığını gösterdiği kare bir matris — olarak görselleştirilir. Bu ısı haritalarındaki daha koyu noktalar veya kareler, genomun şans eseri beklenenden daha sık birbirleriyle etkileşime giren bölgelerini belirtir ve kromatin katlanmasının karmaşık desenlerini ortaya çıkarır.
Bu veriler, genlerin nasıl katlandığını, hangi bölgelerin yakınlaştığını ve düzenleyici elemanların nasıl etkileştiğini ortaya koyar.
Hi-C’nin ve 3D genom organizasyonunun önemi yeterince vurgulanamaz. Kromozomların üç boyutta nasıl organize edildiğine dair ilk kapsamlı, genom çapında ve nispeten yüksek çözünürlüklü görüşleri sağladı. Genom mimarisinin çalışmasını birkaç belirli örnekten küresel bir anlayışa taşıdı, daha önce görülmemiş organizasyon katmanlarını ortaya çıkardı ve bu organizasyonun gen işlevini nasıl etkilediğini anlamak için bir çerçeve sağladı.
Organizasyon hiyerarşileri: Kompartmanlardan TAD’lere
Hi-C verileri, genom organizasyonunun rastgele olmadığını, birkaç farklı katlama seviyesiyle hiyerarşik olduğunu hızla ortaya koydu. Bunlardan ilki ve daha büyük ölçekte olanı “compartment” olarak adlandırılan A ve B kompartmanları (ya da bölmeleri) ve daha küçük ölçekte olan TAD (Topolojik Olarak İlişkilendirilen Alanlar) bölgeleridir.
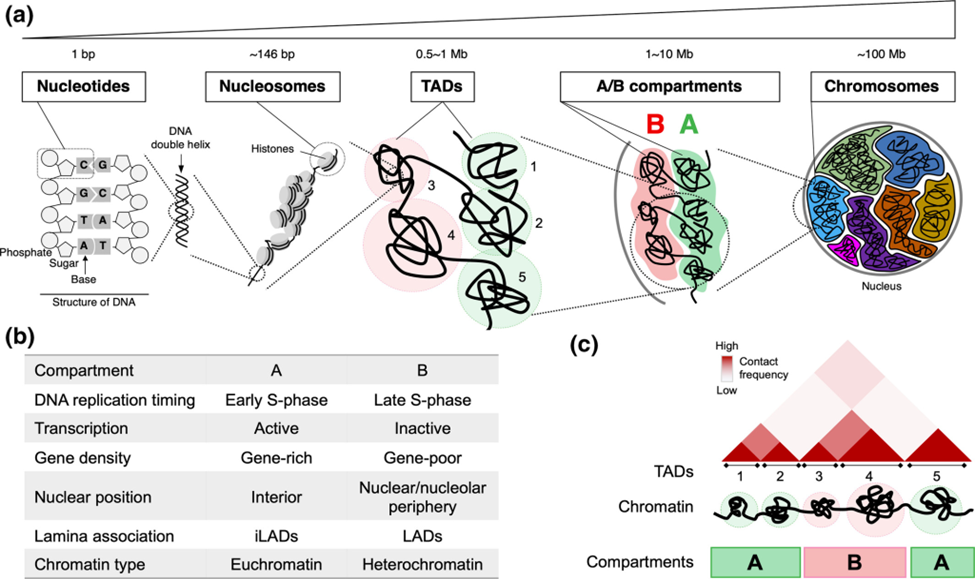
İki “mahalle”: A/B kompartmanları (A/B compartments)
Hi-C haritalarından ortaya çıkan ilk ve en çarpıcı özelliklerden biri, genomun A ve B kompartmanları olarak adlandırılan iki büyük mekânsal bölmeye ayrılmasıdır. Bu bölmeler oldukça büyüktür ve genellikle megabaz (milyonlarca DNA baz çifti) boyutundadır. Bu sınıflandırma, ilk temel bileşen analizi (Principal Component Analysis – PCA) üzerinden yapılan istatistiksel ayrımlarla yapılır. A kompartmanları genellikle aktif genlerin bulunduğu, açık kromatin yapısına sahip bölgelerken; B kompartmanları, daha inaktif, sıkı paketlenmiş heterokromatin bölgelerini temsil eder.
Hi-C haritalarından ortaya çıkan ilk ve en çarpıcı özelliklerden biri, genomun A ve B kompartmanları olarak adlandırılan iki büyük mekânsal bölmeye ayrılmasıdır.
Tahmin edileceği üzere, A kompartmanları aktif kromatinlerle ilişkili olduğundan genler açısından zengin bölmelerdir. Bir başka deyişle, bu bölgeler RNA’ya transkripsiyona uğrayan genleri barındırır. A kompartmanlarındaki kromatin, hücre bölünme döngüsü sırasında erken çoğalma eğilimindedir ve daha “açık” ve erişilebilir bir yapıya sahiptir. Bu açıklık, transkripsiyonel işleyişin genlere daha kolay erişmesini sağlar. Ayrıca, A kompartmanları aktif gen ifadesiyle ilişkili olan histon proteinleri (histon işaretleri) üzerindeki belirli kimyasal modifikasyonlarla zenginleştirilmiştir. A kompartmanlarını genomun hareketli, iyi aydınlatılmış, aktivite dolu şehir merkezleri olarak düşünebiliriz.
Buna karşılık, B kompartmanları genellikle inaktif kromatinle ilişkilidir. Gen açısından fakir olma eğilimindedirler veya gen içeriyorlarsa, bu genler genellikle suskundur ya da çok düşük seviyelerde ifade edilir.
B kompartmanlarındaki kromatin genellikle hücre döngüsünün sonlarında çoğalır ve daha yoğun bir şekilde paketlenir, heterokromatin adı verilen kompakt bir yapı oluşturur. Bu sıkışma, gen ifadesi mekanizmasının DNA’ya erişmesini zorlaştırır. B kompartmanları, baskılayıcı histon işaretleriyle zenginleştirilmiştir. B kompartmanları, her şeyin genellikle kapalı olduğu genomun daha sessiz, daha banliyö veya kırsal alanlarıdır.
Bu kompartman bölgeleri her zaman sabit midir? Yapılan araştırmalar bunun böyle olmadığını göstermektedir.
Bu bölmelendirmenin temel bir özelliği, A kompartmanlarının diğer A kompartmanlarıyla ve B kompartmanlarının diğer B kompartmanlarıyla öncelikli olarak etkileşime girme eğiliminde olmasıdır. Bu öz-ilişkilendirme, farklı kompartmanlardan bölgeler aynı kromozomda olsa veya A ve B segmentleri doğrusal kromozom boyunca serpiştirilmiş olsa bile, çekirdek içindeki bu iki farklı kromatin ortamının mekânsal olarak ayrılmasına yol açmaktadır.
Bölmelendirmenin en can alıcı noktasına gelirsek: Bu kompartman bölgeleri her zaman sabit midir? Yapılan araştırmalar bunun böyle olmadığını ve hatta bir genomik bölgenin A veya B kompartmanına atanmasının bir organizmanın yaşamı boyunca veya hatta farklı hücre tipleri içinde statik olmadığını, tam tersine dinamik olduğunu ve genom bölgelerinin bu kompartmanlar arasında geçiş yapabildiğini göstermiştir.
Bu geçişler, gen ifadesinde köklü değişikliklere yol açabilir.
Dikkat çekici bulgulardan biri, bazı gen bölgelerinin hücre farklılaşması, çevresel etkiler veya hastalık gibi durumlarda A’dan B’ye veya tam tersi yönde geçiş yapabildiğidir. Bu geçişler, gen ifadesinde köklü değişikliklere yol açabilir. Örneğin, bir tümör baskılayıcı genin B kompartmanına kayması, onun sessizleşmesine ve kanser gelişimine katkıda bulunabilir. Aynı şekilde, kök hücrelerde genler çoğunlukla A kompartmanında yer alırken, farklılaşma sürecinde bazıları B’ye geçebilir. Bu geçişlere kısaca bakacak olursak:
A’dan B’ye geçişlerde, genomik bir bölge aktif bir A kompartmanından, aktif olmayan bir B kompartmanına geçebilir. Bu geçişe genellikle o bölgedeki genlerin susturulması eşlik eder. Bu tür geçişler, bir hücre uzmanlaşırken belirli gen kümelerinin kapatılması gereken hücresel farklılaşma sırasında kritik olabilir.
Tam tersine, B’den A’ya geçişlerde ise bir bölge, baskıcı bir B kompartmanından izin verici bir A kompartmanına geçebilir. Bu, genellikle o bölgedeki genlerin aktive olmasına yol açar ve bunların ifade edilmesine olanak tanır. Bu tür bir geçiş, bir hücrenin yeni bir sinyale yanıt vermesi veya durumunu değiştirmesi gerektiğinde meydana gelebilir.
Kanser gibi hastalık durumlarında, tümör hücrelerini karakterize eden kontrolsüz gen ifadesi kalıplarına katkıda bulunan anormal bölme geçişi gözlemlenmiştir.
Bu kompartman geçişleri, büyük ölçekli gen düzenlemesi için güçlü bir epigenetik mekanizmayı temsil eder. Hücre, tüm bir kromozomal alanın daha geniş nükleer ortamını değiştirerek, aynı anda birçok genin ifadesini koordineli bir şekilde kontrol edebilir. Örneğin, kök hücrelerden farklı hücre soylarının gelişimi sırasında A/B bölmelerinin kapsamlı yeniden organizasyonu meydana gelir ve bu da soy-spesifik genlerin aktive edilmesini (A’ya hareket etmesini) ve diğer soylar için genlerin baskılanmasını (B’ye hareket etmesini veya B’de kalmasını) sağlar. Benzer şekilde, kanser gibi hastalık durumlarında, tümör hücrelerini karakterize eden kontrolsüz gen ifadesi kalıplarına katkıda bulunan anormal bölme geçişi gözlemlenmiştir.
Yerel “haneler” : Topolojik olarak ilişkilendirilen alanlar (TAD’ler)
A/B bölmelerinin ölçeğinden yakınlaştırarak, Hi-C verileri organizasyonun başka bir önemli katmanını ortaya çıkardı: TAD’ler (Topologically Associating Domains). A/B bölmeleri büyük mahalleler gibiyse, TAD’ler bu mahalleler içindeki bireysel evler, kapalı siteler veya farklı ev blokları olarak düşünülebilir. TAD’ler, tipik olarak on binlerce ila birkaç milyon baz çifti arasında değişen, kendi içlerinde yoğun temaslara sahip olan ancak dış çevresiyle daha az etkileşimde bulunan DNA bloklarıdır. Hi-C ısı haritalarının köşegeni boyunca belirgin kare benzeri bloklar olarak görünürler.
TAD sınırları, güçlendiricileri doğru hedef genleriyle “birleştirmeye” yardımcı olur.
TAD’ler, genomun nispeten kararlı yapısal ve işlevsel birimleridir ve büyük ölçüde farklı hücre tipleri ve hatta türler arasında korunurlar ki bu da kromozom organizasyonunda temel bir rol oynadıklarını gösterir. TAD’lerin önemleri birkaç temel işlevde yatmaktadır:
Yalıtım: TAD’lerin en kritik rollerinden biri, yalıtkan olarak hareket etmektir. TAD’lerin sınırları, özellikle güçlendiriciler olmak üzere düzenleyici unsurların bir TAD’deki komşu TAD’deki genlerle uygunsuz bir şekilde etkileşime girmesini ve onları aktive etmesini önleyen bariyerler olarak işlev görmektedir. Bu, düzenleyici kesinliği sağlamak için hayati önem taşır. X geni için tasarlanmış bir güçlendirici, bir sonraki TAD’de Y genini kolayca aktive edebilirse, kaotik ve potansiyel olarak zararlı gen ifade kalıplarına yol açabilir. TAD sınırları, güçlendiricileri doğru hedef genleriyle “birleştirmeye” yardımcı olur. Ayrıca, TAD sınırlarının bozulması genetik hastalıklara yol açabilir. Örneğin, TAD sınırlarının silinmesiyle bir enhancer, yanlış bir geni aktive edebilir — bu da kanser ya da doğumsal bozukluklara neden olabilir.
TAD sınırlarının bozulması genetik hastalıklara yol açabilir.
Etkileşimleri Kolaylaştırma: TAD’ler, bu nispeten kendi kendine yeten alanları oluşturarak aynı zamanda DNA’nın yerel konsantrasyonunu da artırır. Bu, aynı TAD içinde bulunan genlerin ve bunların spesifik düzenleyici unsurlarının (güçlendiriciler ve promotörler gibi) birbirleriyle fiziksel olarak karşılaşma olasılığını artırır ve bu da uygun etkileşimlerini ve gen ifadesinin ince ayarını kolaylaştırır. Esasen gen düzenlemesi için lokalize “reaksiyon potaları” oluştururlar.
Yapısal Birimler: TAD’ler, daha yüksek dereceli kromozom mimarisinin temel yapı taşları olarak kabul edilir. Daha fazla katlanma ve sıkışmanın meydana gelebileceği bir çerçeve sağlarlar.
TAD’lerin oluşumu ve bakımı, spesifik mimari proteinlere bağlıdır. En önemli oyunculardan ikisi CTCF (CCCTC-bağlayıcı faktör) ve kohezin kompleksidir. CTCF, genellikle TAD sınırlarında bulunan spesifik DNA dizilerine bağlanabilen bir proteindir. İki bitişik TAD’nin kenarlarındaki CTCF bölgelerinin, belki de kohezinin (DNA ipliklerini çevreleyebilen halka şeklinde bir protein kompleksi) yardımıyla bir kromatin halkasının tabanını oluşturmak üzere bir araya gelebileceği düşünülmektedir. Halkanın içindeki DNA, TAD’yi oluşturur. Kohezinin, belirli bir şekilde yönlendirilmiş CTCF bölgeleriyle karşılaşana kadar aktif olarak bir kromatin halkası ekstrüde ettiği bu “döngü ekstrüzyonu” modeli (bir ipin, ip boyunca kayan ve arkasında büyüyen bir halka oluşturan bir halkadan geçirilmesi olarak hayal edebilirsiniz), TAD’lerin nasıl oluştuğuna dair önde gelen bir hipotezdir. Bu proteinler, bu düzenleyici blokları tanımlayan ve ayıran moleküler zımbalar veya sınır belirteçleri gibi davranırlar.
3D genomun senfonisi: Gen ifadesini yönetmek
Genomun 3 boyutlu kompartman ve TAD organizasyonu, gen ifadesi üzerinde doğrudan etkili bir katmandır. 3D mimarisi, hangi genlerin açılıp kapatılacağını, ne kadar güçlü bir şekilde ve hangi sinyallere yanıt olarak yönlendirileceğini yöneten bir çerçeve sağlar. Örneğin, bir genin aktif hâle gelebilmesi için onu düzenleyen enhancer’ın aynı TAD içinde bulunması ve A kompartmanında yer alması gerekebilir.
Daha önce belirtildiği gibi, güçlendiriciler doğrusal DNA dizisinde düzenledikleri genlerden çok uzakta bulunabilir. TAD’ler, bu uzun menzilli etkileşimleri etkinleştirmede önemli bir rol oynar. Bir TAD’nin sınırlı alanı içinde, kromatin lifi döngüye girecek kadar esnektir ve uzaktaki bir güçlendiriciyi, hedef geninin promotörüyle yakın fiziksel yakınlığa getirir. Bu döngü genellikle belirlidir; belirli bir TAD içindeki bir güçlendirici, aynı TAD içindeki promotörlerle tercihen etkileşime girecektir.
3D mimarisi, hangi genlerin açılıp kapatılacağını, ne kadar güçlü bir şekilde ve hangi sinyallere yanıt olarak yönlendirileceğini yöneten bir çerçeve sağlar.
Bir TAD’yi bir oda olarak düşünün. Bir duvardaki ışık anahtarı (güçlendirici), karşı duvardaki bir lambayı (genin promotörü) kontrol edebilir; çünkü ikisi de aynı odadadır ve kablolama (kromatin döngüsü) bunları birbirine bağlayabilir. Işık anahtarı, bitişik bir odada (farklı bir TAD) olsaydı, TAD sınırı (duvar), genellikle ilk odadaki lambayı kontrol etmesini engellerdi. Bu hassas kontrol, genlerin yalnızca belirlenmiş güçlendiricileri tarafından etkinleştirilmesini sağlayarak çapraz konuşmayı önler ve hücresel süreçlerin doğru şekilde gerçekleştirilmesini sağlar. Bu tür döngülerin veya güçlendiricilerin kendilerinin bozulması, hatalı gen aktivasyonuna veya susturulmasına yol açabilir.
Kompartman değiştirme ve büyük ölçekli gen düzenlemesi
A/B kompartmanlarının dinamik yapısı, gen ifadesini bireysel güçlendirici-promotör döngülerinden çok daha geniş bir ölçekte düzenlemek için bir mekanizma sağlar. Potansiyel olarak birçok gen içeren büyük bir genomik bölge, aktif A kompartmanından pasif B’ye geçtiğinde, genellikle o bölgedeki çoğu genin koordineli bir şekilde susturulmasına yol açar. Bu tür büyük ölçekli düzenleme, hücreler özel tiplere farklılaştıkça gelişim sırasında kritik öneme sahiptir. Örneğin, bir kök hücre nöron hâline geldiğinde, kas fonksiyonu için gerekli genler B kompartmanına taşınıp susturulabilirken, nörona özgü genler aktif ifadelerini sağlamak için A kompartmanında tutulabilir veya B’den A’ya taşınabilir. Bu koordineli kontrol, gen ifadelerinde değişimleri kontrol ederek farklı hücresel kimliklerin oluşturulmasını ve sürdürülmesini sağlar.
3D mimarinin bozulması
3D genom organizasyonunun normal gen düzenlemesindeki kritik rolü göz önüne alındığında, bu mimarideki bozulmaların gelişimsel bozukluklar ve kanser de dahil olmak üzere çeşitli hastalıklara yol açarak ciddi sonuçlara neden olabileceği belirtilmiştir. Peki, bu neden oluyor?
Birkaç insan gelişim sendromu (örneğin, belirli uzuv malformasyonları) TAD sınırlarını değiştiren ve temel gelişimsel genlerin yanlış ifadesine neden olan yapısal varyasyonlarla ilişkilendirilmiştir.
DNA’nın silinmesi veya eklenmesi gibi mutasyonlar TAD sınırlarını bozabilir. Bir TAD sınırı zayıflarsa veya kaybolursa, “enhancer hijacking” denen güçlendiricinin otostopçu olup başka bloklara gitmesine yol açabilir. Bu senaryoda, bir TAD’den gelen bir güçlendirici, bitişik bir TAD’deki bir gene erişebilir ve uygunsuz bir şekilde etkinleştirebilir. Bu yeni etkinleştirilen gen bir onkogense (aşırı aktif olduğunda kanseri teşvik edebilen bir gen), bu tümör oluşumunu tetikleyebilir. Benzer şekilde, bir gen normal güçlendiricisinden izole olabilir; bu da susturulmasına ve normal gelişim için bu gen çok önemliyse potansiyel olarak bir gelişimsel bozukluğa neden olabilir. Birkaç insan gelişim sendromu (örneğin, belirli uzuv malformasyonları) TAD sınırlarını değiştiren ve temel gelişimsel genlerin yanlış ifadesine neden olan yapısal varyasyonlarla ilişkilendirilmiştir.
Anormal A/B kompartman geçişleri, kanser gibi hastalıkların ayırt edici özelliklerinden biri olarak tanınmaktadır. Örneğin, tümör baskılayıcı genler içeren bölgeler (normalde hücre büyümesini kısıtlar) uygunsuz bir şekilde A’dan B bölmesine geçebilir; bu da susturulmalarına ve kontrolsüz hücre çoğalmasına katkıda bulunabilir. Tersine, onkogenlere sahip bölgeler B’den A’ya geçerek aşırı ifadelerini teşvik edebilir. Bu bölme değişikliklerini incelemek, hastalık mekanizmalarına ilişkin içgörüler sağlayabilir ve potansiyel olarak yeni terapötik hedefler belirleyebilir.
Anormal A/B kompartman geçişleri, kanser gibi hastalıkların ayırt edici özelliklerinden biri olarak tanınmaktadır.
Translokasyonlar (bir kromozomun bir parçasının kopup diğerine bağlanması) veya inversiyonlar (bir kromozom segmentinin ters çevrilmesi) gibi daha büyük kromozomal düzenlemeler, 3 boyutlu genom temaslarını büyük ölçüde değiştirebilir; genleri yeni düzenleyici ortamlara taşıyabilir veya mevcut olanları bozabilir; bu da gen ifadesi ve hücre sağlığı üzerinde derin etkilere neden olabilir.
Dinamik etkileşim: Sadece yapı değil, yaşayan bir süreç
3D genomun statik, katı bir iskele olmadığını hatırlamak önemlidir. Bunun yerine, çeşitli ipuçlarına ve hücresel süreçlere yanıt olarak değişen oldukça dinamik bir yapıdır. Kromatinin organizasyonu farklı durumlarda ve zamanlarda değişim gösterebilir; ki bu da gelişim ve hücrelerin farklılaşabilmesi için gerekli olan gen ifadelim çeşitliliği için önem arz etmektedir. Bu değişim olaylarından örnek verecek olursak, değişimin en yoğun olduğu dönem gelişim dönemidir. Bir organizma tek bir döllenmiş yumurtadan karmaşık çok hücreli bir varlığa dönüşürken, hücreler yüzlerce özel türe farklılaşır.
Belirli bir uyarana maruz kalma, belirli bir genin döngüye girmesine ve bir güçlendirici ile etkileşime girmesine neden olabilir; bu da onun hızlı aktivasyonuna yol açabilir.
Her farklılaşma adımı, hücre türüne özgü gen ifade programlarını oluşturmak ve sürdürmek için 3D genomun kapsamlı bir şekilde yeniden düzenlenmesini içerir. Bu değişimler, hücre döngüleri sırasında kromozomların hücre bölünmesinden (mitoz) önce dramatik bir yoğunlaşmaya uğraması ve ardından yoğunlaşmayı bırakması sırasında gerçekleşir. Ayrıca gelişime ek olarak kromozom organizasyonları, dış sinyallere yanıt olarak da değişime uğrayabilir.
Hücreler sürekli olarak çevrelerinden sinyaller alırlar (örneğin, hormonlar, büyüme faktörleri, stres). Bu sinyaller, kromatin mimarisinde değişikliklere neden olabilir ve hücrelerin gen ifadelerini uyarlamalarına ve uygun şekilde yanıt vermelerine olanak tanır. Örneğin, belirli bir uyarana maruz kalma, belirli bir genin döngüye girmesine ve bir güçlendirici ile etkileşime girmesine neden olabilir; bu da onun hızlı aktivasyonuna yol açabilir.
3D genomun statik, katı bir iskele olmadığını hatırlamak önemlidir. Bunun yerine, çeşitli ipuçlarına ve hücresel süreçlere yanıt olarak değişen oldukça dinamik bir yapıdır.
Genom dizisi, epigenetik modifikasyonlar ve 3 boyutlu mimarisi arasındaki bu dinamik etkileşim, uzay ve zamanda gen ifadesinin hassas bir şekilde kontrol edilmesine olanak tanıyan, karmaşık ve uyarlanabilir bir yaşam sağlayan sofistike bir düzenleyici sistem yaratır.
3D genomiğin ve epigenetiğin geleceği
3D genom organizasyonunun incelenmesi hızla ilerleyen bir alandır ve anlayışımız sürekli olarak geliştirilmektedir. Teknoloji ilerledikçe genomun 3D haritası da daha ayrıntılı hâle gelmekte, hatta tek hücre düzeyinde Hi-C analizleri yapılabilmektedir. Ayrıca, epigenetik veriler (metilasyon, histon modifikasyonları) ve transkriptom verileriyle Hi-C verileri entegre edilerek daha bütüncül bir anlayış geliştirilmektedir. Yapay zeka ve makine öğrenme yöntemlerindeki gelişmeler sayesinde Hi-C gibi yöntemlerle elde edilen karmaşık verilerden anlamlı desenler çıkarmamız daha da kolaylaşmaktadır.
Tüm bu gelişmeler, belki de gelecekte kişiye özel epigenetik düzenlemelerin, gen terapilerinin ve kanser teşhislerinin daha hassas hâle gelmesini sağlayabilir. Bu yöntemlere paralel gelişebilecek olan teknoloji sayesinde belki daha derin çözünürlüğe ulaşarak belirli bir protein özelinde DNA organizasyonları incelenerek çok daha verimli çalışmalar gerçekleştirilebilir ve tek bir protein ile ilişkili hastalıklar çözümlenebilir. Ya da 3 boyutlu yapıya ek olarak 4. boyut olarak zaman kullanımı sayesinde gelişim sırasında gerçekleşen değişimler çok daha anlamlı bir şekilde yorumlanabilir.
Tüm bu gelişmeler, belki de gelecekte kişiye özel epigenetik düzenlemelerin, gen terapilerinin ve kanser teşhislerinin daha hassas hâle gelmesini sağlayabilir.
Özetle; 3 boyutlu genom organizasyonundaki değişimlerin ve bozulmaların gelişime, gen ifadelerindeki değişimlere ve hastalıklara nasıl katkıda bulunduğu hakkında daha fazla şey öğrendikçe, bir gün kanser veya gelişimsel bozukluklar gibi hastalıklarda hatalı kromatin katlanmasını düzeltmek için ilaçlar veya gen terapileri tasarlayabilir miyiz? Bu uzun vadeli bir hedeftir, ancak bugün inşa edilen temel bilgi önemlidir.
Sonuç: DNA’yı okumak yeterli değil, katlamak da gerek
Genetik kod, yaşamın temelidir. Ancak bu kodun nasıl dizildiği kadar, hücre çekirdeğinde nasıl katlandığı da büyük önem taşır. DNA’nın üç boyutlu yapısı, genlerin ne zaman, nerede ve ne düzeyde çalışacağını etkileyen kritik bir faktördür. Epigenetik, artık yalnızca kimyasal işaretlerle değil, bu mekânsal organizasyonla da ilgileniyor.
Hi-C gibi gelişmiş yöntemler sayesinde, genomun mekânda nasıl düzenlendiğini ve bu düzenin gen ifadesi üzerindeki etkilerini daha iyi anlayabiliyoruz. A/B kompartmanları, TAD’ler ve loop extrusion gibi kavramlar, genlerin içinde bulunduğu “ortamı” tanımlamamıza yardımcı oluyor. Aynı DNA dizisine sahip hücrelerin nasıl farklı özellikler kazanabildiği sorusunun yanıtı da burada gizli.
Epigenetik, artık yalnızca kimyasal işaretlerle değil, bu mekânsal organizasyonla da ilgileniyor.
Bu durumu bir kütüphane gibi düşünebiliriz: DNA dizisi, kütüphanedeki tüm kitapların içeriğini temsil eder. Ancak bu kitapların nasıl raflandığı, hangilerinin kolay erişilebilir olduğu ya da hangilerinin arka raflara gizlendiği, bilgiye ulaşımı doğrudan etkiler. Genomun katlanma biçimi de aynen böyledir—genlerin içeriği kadar, nerede ve nasıl konumlandıkları da işlevlerini belirler.
Gelecekte hastalıkların teşhisi ve tedavisi yalnızca DNA dizisine bakılarak değil, DNA’nın hücre içinde nasıl organize olduğuna göre şekillenecek. Kısacası, genetik bilgi kadar, bu bilginin üç boyutlu yapıda nasıl sunulduğu da biyolojinin anahtarı hâline geliyor.
Kaynakça
Aboud, N. M. Al, Tupper, C., & Jialal, I. (2023). Genetics, Epigenetic Mechanism. StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK532999/
Dekker, J., Rippe, K., Dekker, M., & Kleckner, N. (2002). Capturing Chromosome Conformation. Science, 295(5558), 1306–1311. https://doi.org/10.1126/science.1067799
Gibcus, J. H., & Dekker, J. (2013). The Hierarchy of the 3D Genome. Molecular Cell, 49(5), 773–782. https://doi.org/10.1016/j.molcel.2013.02.011
Handy, D. E., Castro, R., & Loscalzo, J. (2011). Epigenetic Modifications: Basic Mechanisms and Role in Cardiovascular Disease. Circulation, 123(19), 2145. https://doi.org/10.1161/CIRCULATIONAHA.110.956839
Lajoie, B. R., Dekker, J., & Kaplan, N. (2014). The Hitchhiker’s Guide to Hi-C Analysis: Practical guidelines. Methods (San Diego, Calif.), 72(C), 65. https://doi.org/10.1016/J.YMETH.2014.10.031
Poonperm, R., & Hiratani, I. (2021). Formation of a multi-layered 3-dimensional structure of the heterochromatin compartment during early mammalian development. Development, Growth & Differentiation, 63(1), 5–17. https://doi.org/10.1111/DGD.12709
van Berkum, N. L., Lieberman-Aiden, E., Williams, L., Imakaev, M., Gnirke, A., Mirny, L. A., Dekker, J., & Lander, E. S. (2010). Hi-C: A Method to Study the Three-dimensional Architecture of Genomes. Journal of Visualized Experiments : JoVE, 39, 1869. https://doi.org/10.3791/1869
Zhang, Y. W., Chen, L., & Li, S. C. (2022). Detecting TAD-like domains from RNA-associated interactions. Nucleic Acids Research, 50(15), e88. https://doi.org/10.1093/NAR/GKAC422










